Šta je struktura atoma
Šta je atom?
Naziv za najmanji delić supstance potiče od grčke reči ατομον ( čita se atomon ), a u značenju nedeljiv. Definicija atoma glasi: “ Atom je najmanji dečić supstance, to jest hemijskog elementa koji ispoljava sve osobine tog hemijskog elementa. “
Tako kaže definicija, koju mahom svi mi učimo napamet. A da bismo bolje razumeli šta je to atom, valjalo bi da dodamo i da atom čine tri grupe čestica, i to takozvanih subatomskih čestica. Subatomske čestice su: elektroni, protoni i neutroni. Elektroni su subatomske čestice koje imaju negativno naelektrisanje i izuzetno malu masu. Protoni i neutroni su subatomske čestice jedinične mase, s tim što su protoni pozitivno naelektrisani, dok neuroni uopšte nemaju naelektrisanje.
Struktura atoma
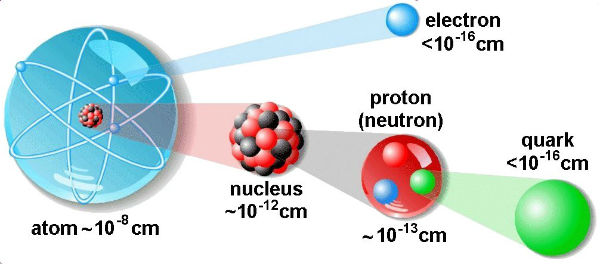
Struktura atoma je zapravo sastav atoma. Svaki atom čine jezgro i omotač atoma.
Atomsko jezgro je sastavljeno od protona i neutrona. Simbol svakog atoma sadrži takozvani Atomski, odnosno Redni broj ( Z ), uvek se beleži dole i pomoću njega saznajemo kom hemijskom elementu pripada atom, a određen je brojem protona ( N ). Broj koji se uvek beleži beleži gore je Atomska masa, odnosno Maseni broj ( A ).
Pa tako, Atomski broj je: Z = N ( p+), a Atomska masa je: A = N ( p+) + N ( n0)
U primeru, recimo kiseonika, Atomski broj je 8, dok je Atomska masa 16.
Omotač atoma ili takozvani elektronski omotač, kako mu i sam naziv kaže čine elektroni.
Vrlo je bitno napomenuti da atomi imaju isti broj protona i elektrona, dok katjoni, to jest pozitivni joni imaju manje elektrona u odnosu na atome, a anjoni, to jest negativni joni imaju više elektrona u odnosu na atome.
Privlačne sile koje deluju u unutrašnjosti svakog atoma čine da je struktura atoma stabilna. Atomi sa brojem elektrona od 1 pa do 95 postoje u prirodi, dok su veštački stvoreni do broja 109.
Elementarne čestice – definicija
Kao definicija za elementarne čestice, najčešće se koristi sledeća: “ Elementarne čestice su subatomske čestice za koje se veruje da se ne mogu podeliti na manje. “ Treba napomenuti da se pod pojmom subatomskih čestica smatraju sve čestice koje su manje od atoma, a bez obzira na njihovu složenost.
Elementarne čestice mogu biti i stabilne i nestabilne. A sve elementarne čestice se dele na dve grupe: čestice materije i čestice prenosioca sila.
Čestice materije su one elementarne čestice koje su sastavni delovi: živih bića, atoma, molekula i uopšte svega što nas okružuje. U ovu grupu spadaju: kvarkovi i leptoni. Pod kvarkovima se podrazumevaju elementarne čestice koje imaju spin ( definicija: “ Spin je osnovna osobina elementarne čestice, poput mase i naelektrisanja. “ ) 1/2, kao što ga imaju i sve ostale materijalne čestice, ali kvarkovi imaju električni naboj 1/3c, te imaju i osobinu znanu kao boja ( koja može imati tri osnovne vrednosti ). Kvarkova ima ukupno 6 vrsta i oni su podeljeni u 3 para: u – d ( up – down ), t – b ( top – botom ) i c – s ( charm – strange ).
Prvi par kvarkova, u – p ( up – down ) imaju najmanju masu i najmanju energiju, pa fizika smatra da upravo ove elementarne čestice čine ceo kosmos, jer su najstabilnije. Ostala dva para kvarkova su mnogo masivniji od u – p / up – down ) para.
Leptoni predstavljaju one elementarne čestice koje učestvuju u važnim fizičkim procesima, ali ne prave druge složene čestice. I one imaju spin iste vrednosti kao i kvarkovi, 1/2, ali im je naelektrisanje 1c. Masa im je znatno manja od kvarkova i mogu se naći slobodni, za razliku od kvarkova koji se uvek i jedino mogu naći povezani u čestice.
Postoji ukupno 6 vrsta leptona, to jest 3 vrste: elektron, muon i tau i njihovi odgovarajući neutrini: elektronski neutrino, muonski neutrino i tau neutrino.
Elektron i njegov neutrino su “ leptoni koji čine kosmos „, jer imaju najmanju masu, dok ostali imaju mnogo veću masu, a mogu da nastanu ili u akceleratorima ili pri reakcijama koje se odvijaju u jezgrima zvezda.
Struktura atoma i molekula
Struktura atoma je u neposrednoj vezi sa molekulima, jer svaki molekul u sebi sadrži atome.
Struktura atoma i nuklearne sile
U svakom atomu vladaju sve one iste sile koje vladaju i u prirodi, a to su: gravitacione, elektromagnetne i nuklearne.
Uticaj gravitacionih sila je zanemaljiv zbog malih masa, ali one ipak deluju između svih atomskih čestica.
Elekromagnetne sile u jednom atomu deluju između protona, koji se nalazi u jezgru atoma i elektrona, koji se nalazi u omotaču.
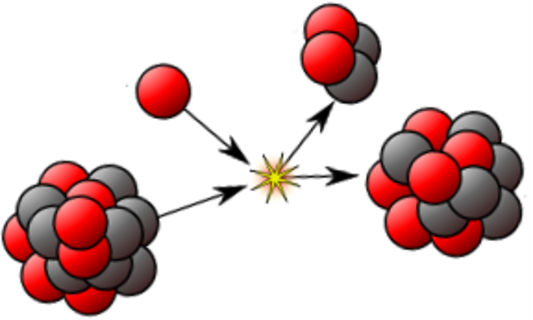
I nuklearne sile koje deluju u atomu imajuvrlo važan uticaj. One mogu biti jake i slabe. Jake nuklerne sile deluju u jezgru i to između: protona i protona ili neutrona i neutrona ili između protona i neutrona. Ove sile deluju na izuzetno malim rastojanjima, a svojim delovanjem savladavaju sile elektrostatičkog odbijanja između protona, formirajući jezgro. Sa druge strane i nuklearne sile koje se smatraju slabim, dovode do promena u atomu. Naime, usled dejstva ostalih, ali i nuklearnih sila dolazi do transformacije protona i neutrona, te to dovodi ili do transformacije ili do raspada jezgra.
Struktura atoma i radiokativnost
Pojava koja je danas poznata kao radioaktivnost otkrivena je krajem 19. veka. Naime, posmatrajući atome, Anri Bekerel je otkrio da određeni elementi koji imaju velike masene brojeve emituju zračenje. Utvrdio je da je prisutno takozvano alfa zračenje i radiokativnost, kako je nazvao ovu pojavu.
Pod pojmom alfa zračenje se podrazumeva snop alfa čestica koje izleću iz jezgra, a svaka alfa čestica je sačinjena od 2 protona i 2 neutrona. Reč je, zapravo o jezgrima helijuma, koji predstavljaju pozitivno naelektrisane čestice. Da postoji alfa zračenje i radioaktivnost je utvrđeno pomoću rude urana, koja u sebi sadrži helijum u gasovitom stanju. Taj helijum u rudi nastaje na sledeći način: alfa čestica se zaustavi u rudi, zahvati 2 elektrona iz neposredne okoline i na taj način nastaje atom helijuma. Kada dođe do raspada jezgra urana, oslobađa se velika količina energije, čiji je veći deo upravo alfa čestica, koja usled male masa ima znatno veću brzinu. Kada kažemo velika količina energije, misli se na energiju koja je čak nekoliko puta veća od one koja nastaje usled delovanja atoma u reakcijama, kojima se bavi hemija.
Dat je samo primer urana, mada postoje i drugi elementi u kojima je prisutno alfa zračenje i radioaktivnost.
Struktura atoma i Periodni sistem elemenata
Svakako je prva asocijacija na Periodni sistem elemenata kod mnogih istovetna, a to je hemija. Mada ni hemija ni fizika ne moraju biti toliko “ teške “ za učenje, ukoliko sve pojmove shvatite. Zato ćemo pokušati da vam približimo ovaj vrlo važan pojam, kao i vezu koju imaju struktura atoma i Periodni sistem elemenata.
Prvobitni Periodni sistem je nastao još kada se sa sigurnošću nije znala struktura atoma. Inače, njegova definicija bi bila: “ Periodni sistem elemenata je prikaz poznatih hemijskih elemenata, koji su složeni prema elektronskoj strukturi. “
Početkom 19. veka je otkriveno da ukoliko se svi poznati hemijski elementi slože prema Atomskoj masi, a uz Atomsku masu se stave i neke druge osobine tih elemenata, javlja se takozvano periodno kretanje svih tih osobina, a što je, opet u vezi upravo sa Atomskom masom.
Nedugo nakon ovog otkrića je usledilo novo i to da se poznati hemijski elementi slične vrste pojavljuju u pravilnim razmacima, to jest periodično u intervalima od 8 elemenata. Engleski hemičar koji je uočio ovu pravilnost je uporedio muzičku oktavu i Periodni sistem elemenata, ali je bio ismejan tada.
Nakon svih ovih otkrića, 1869. godine je Dmitrij Ivanovič Mendeljejev, ruski hemičar je napravio prvi Periodni sistem elemenata, u kome su svi poznati hemijski elementi bili poređani po Atomskoj masi. Hemija kao nauka priznaje brojne zasluge ruskom naučniku, jer je pored toga što je stvorio i Periodni sistem elemenata, uspeo da, između ostalog predvidi postojanje, ali i osobine pojedinih hemijskih elemenata koji još uvek nisu bili otkriveni.